CÔNG NGHỆ HÓA LÝ
1. CÔNG NGHỆ HÓA LÝ?
Cơ sở của công nghệ hóa lý là việc đưa vào nước thải các hóa chất để tạo ra các phản ứng hóa học.
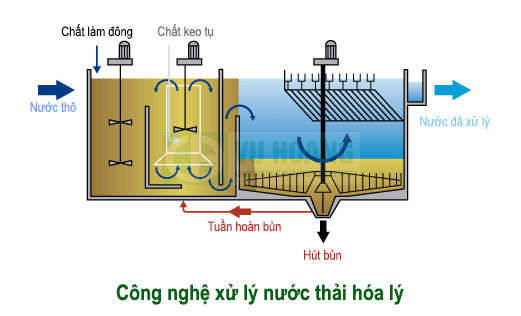
Những phản ứng diễn ra có thể là phản ứng oxy hoá khử, các phản ứng tạo chất kết tủa hoặc các phản ứng phân huỷ chất độc hại. Các phương pháp hoá học là oxy hoá, trung hoà và keo tụ (hay còn gọi là đông tụ). Thông thường đi đôi với trung hoà có kèm theo quá trình keo tụ. Thông qua đó sẽ loại bỏ được các chất bẩn ở dạng cặn lắng hoặc dạng hòa tan không độc hại.

2. NGUYÊN LÝ XỬ LÝ
Các quá trình xử lý hóa học được trình bày tóm tắt như sau:
Trung hòa:
Nước thải chứa các axit hoặc kiềm cần được trung hòa để đưa giá trị pH của nước về ngưỡng trung tính.
Keo tụ – tạo bông:
Trong nguồn nước, một phần các hạt thường tồn tại ở dạng các hạt keo mịn phân tán, kích thước của hạt thường dao động trong khoảng 0,1 đến 10 mm. Các hạt này không nổi cũng không lắng, và do đó tương đối khó tách loại.
- Do đó, để phá tính bền của hạt keo cần trung hòa điện tích bề mặt của chúng, quá trình này được gọi là quá trình keo tụ.
- Các hạt keo đã bị trung hòa điện tích có thể liên kết với những hạt keo khác tạo thành bông cặn có kích thước lớn hơn, nặng hơn và lắng xuống, quá trình này được gọi là quá trình tạo bông.
Quá trình thủy phân các chất keo tụ và tạo thành bông cặn xảy ra theo các giai đoạn sau:
Me3+ + HOH ® Me(OH)2+ + H+
Me(OH)2+ + HOH ® Me(OH)+ + H+
Me(OH)+ + HOH ® Me(OH)3 + H+
——————————————————–
Me3+ + HOH ® Me(OH)3 + 3H+
Những chất keo tụ thường dùng nhất là các muối sắt và muối nhôm như:
Al2(SO4)3, Al2(SO4)18H2O, NaAlO2, Al2(OH)5Cl, Kal(SO4)2.12H2O, NH4Al(SO4)2.12H2O.
FeCl3, Fe2(SO4)2H2O, Fe2(SO4)2.3H2O, Fe2(SO4)2.7H2O.
Phá màu:
Hóa chất phá màu được thêm vào ở quá trình keo tụ, nhằm loại bỏ hoàn toàn màu trong nước thải.
Oxi hóa bậc cao:
Công nghệ này thường được áp dụng trong xử lý nước thải có nồng độ COD khó phân hủy và độ màu cao. Quá trình oxy hóa có thể được sử dụng tại bước xử lý bậc cao để loại bỏ COD và độ màu còn lại hoặc được sử dụng tại bước xử lý hóa học đầu tiên (trước khâu xử lý sinh học) nhằm nâng tỉ lệ BOD/COD.
Hệ tác nhân Fenton đồng thể (Fenton cổ điển) là một hỗn hợp gồm các ion sắt hóa trị 2 và H2O2, chúng tác dụng với nhau sinh ra các gốc tự do *HO, còn Fe2+ bị oxi hóa thành Fe3+.
Fe2+ + H2O2 ® Fe3+ + *HO + OH– (k = 63 l.mol-1.s-1) (1.1)
Phản ứng này được gọi là phản ứng Fenton vì Fenton là người đầu tiên đã mô tả quá trình này năm 1894.
Những ion Fe2+ mất đi sẽ được tái sinh lại nhờ Fe3+ tác dụng với H2O2 dư theo phản ứng:
Fe3+ + H2O2® Fe2+ + H+ + *HO2. (k < 3.10-3 l.mol-1.s-1) (1.2)
Từ những phản ứng trên chứng tỏ tác dụng của sắt đóng vai trò là chất xúc tác. Quá trình khử Fe3+ thành Fe2+ xảy ra rất chậm, hằng số tốc độ phản ứng rất nhỏ so với phản ứng (1.1), vì vậy sắt tồn tại sau phản ứng chủ yếu ở dạng Fe3+.
Gốc *HO sinh ra có khả năng phản ứng với Fe2+ và H2O2, nhưng quan trọng nhất là là có khả năng phản ứng với nhiều chất hữu cơ tạo thành các gốc hữu cơ có khả năng phản ứng cao.
*HO + H2O2 ® H2O + *HO2 (1.3)
*HO + Fe2+ ® OH– + Fe3+ (1.4)
*HO + RH ® H2O + *R (1.5)
Gốc *R có thể oxy hóa Fe2+, khử Fe3+ hoặc dimer hóa theo những phương trình phản ứng sau:
*R + Fe2+ ® Fe3+ + RH (1.6)
*R + Fe3+ ® Fe2+ + “sản phẩm” (1.7)
*R + *R ® “sản phẩm” (1.8)
Gốc *HO2 có thể tác dụng với Fe2+, Fe3+ theo các phương trình phản ứng sau:
*HO2 + Fe2+ ® HO2– + Fe3+ (1.9)
*HO2 + Fe3+ ® H+ + O2 + Fe3+ (1.10)
Phương trình phản ứng Fenton tổng cộng có dạng:
Fe2+ + H2O2 + RH ® Fe3+ + H2O + CO2 (1.11)
3. Ưu, nhược điểm
Ưu điểm:
- Loại bỏ được phần lớn chất rắn lơ lửng (80-90% TSS), BOD5(40-70%), COD (30-40%), một phần chất dinh dưỡng (Nitơ, Phốt pho), kim loại nặng và vi sinh vật.
- Xử lý được chất ô nhiễm kích thước nhỏ dạng keo.
Nhược điểm:
- Tạo ra lượng bùn lớn, tốn kém chi phí xử lý bùn.
- Tiêu tốn lượng hóa chất lớn.
Phạm vi áp dụng công nghệ hóa lý:
- Áp dụng trước hoặc sau xử lý sinh học
- Nước thải công nghiệp nhiều chất ô nhiễm vô cơ hoặc trơ mà quá trình xử lý sinh học không xử lý được.
- Các công trình có công suất từ nhỏ đến lớn.

 Zalo
Zalo Chỉ đường
Chỉ đường